Американските регулатори настояват фармацевтичната компания "Pfizer" да кандидатства за спешно получаване на разрешение за употреба на двудозовата й ваксина срещу COVID-19 за деца на възраст от 6 месеца до 5 години. Целта е да се проправи пътят към поставяне на ваксини още от края на февруари, съобщи за Асошиейтед прес запознат източник.
Очаква се документите на компанията за кандидатстване да бъдат подадени още във вторник. По-рано данните на "Pfizer" показаха, че ваксината със сила една десета от тази за възрастни, прилагана на по-малки деца, е безопасна и създава имунен отговор. Но миналата година компанията обяви, че е доказано, че двудозовата ваксина е по-малко ефективна за предотвратяване на коронавирус при деца на възраст от 2 до 5 години.
Затова регулаторите насърчиха компанията да прибави и трета доза към проучването, водени от убеждението, че допълнителна доза ще засили ефективността на ваксината по подобие на бустерната доза при възрастни.
Сега федералната администрация по храните и лекарствата настоява компанията да подаде документи въз основа на данните от прилагането на две дози за потенциално одобрение през февруари. След това да се върне за допълнително разрешение, разполагайки вече с данни от проучване за третата доза, които се очакват през март, каза още източникът.
Двустепенното разрешение означава, че малките деца може да започнат да бъдат ваксинирани повече от месец преди първоначалните прогнози, в случай че Агенцията за контрол на храните и лекарствата и Центровете за контрол и превенция на заболяванията дадат зелена светлина.
Още от категорията

Русия обяви, че контролира село в Източна Украйна

Обмислят как да експонират по-добре "Мона Лиза" в Лувъра

Франция ще разследва сексуалните посегателства в кино средите
Акценти






Традиция на 2500 г.: Защо боядисваме яйца на Великден
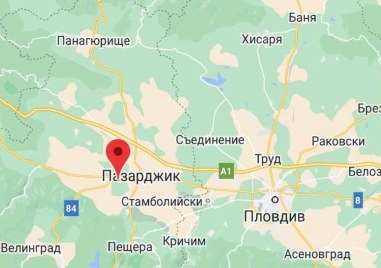
Земетресение с магнитуд 3 по Рихтер разтресе Пазарджишко








